马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?立即注册

x
 ) N! _6 w# j- i4 v3 [& t& m
) N! _6 w# j- i4 v3 [& t& m
- M5 e4 N. L7 n& \) p
目录
6 O, w5 a( R9 J, f5 c* o9 O( B4 ]9 \3 w0 Q
 & {& c) Y: o: Q* o3 k2 {( R
& {& c) Y: o: Q* o3 k2 {( R
7 S5 e$ G* c0 @5 k6 |影像引导下热消融治疗原则(NSCL-D)( Q$ n# F3 b& T! I/ O% A
) ?, @' l5 C# j% M- m c5 r4 o
一般原则
0 R) }/ b0 X: G) {●介入放射科医生应积极参加有关NSCLC患者的多学科讨论和会议(例如,多学科会诊和/或肿瘤委员会)。: o6 w3 B$ G+ F
●关于消融是否可行的决定应由进行IGTA的介入放射科医生来进行决策,这是他们实践的一个重要部分。% u4 A; ?1 e1 D8 R$ s
●IGTA包括射频消融、微波消融和冷冻消融。IGTA是“局部治疗”或“局部消融治疗”的一种形式。1! M" |) \) e9 i2 J& c# q
●IGTA是一种保留肺实质的技术,至多出现FEV1和DLCO暂时性降低,据统计恢复后与基线水平没有区别。2-6: S# o9 T; d! v% U' d, d7 E$ d0 Z
' m' _3 u# U7 Y, n4 u/ K( F& H7 `8 O
评估
$ t9 ]; N0 j8 q/ c1 u, M$ U●对于那些被认为是“高风险”的患者,可以考虑行IGTA。这些患者的肿瘤大部分可以通过手术切除,但由于合并症在医学上无法手术。如果考虑将IGTA用于高风险或临界可手术患者,则建议进行多学科评估。: O: `! Y5 y; b. O
●IGTA已经成功地用于治疗被认为是“高风险”的患者。所谓“高风险”,被客观地定义为符合1个主要标准和/或≥2个次要标准。主要标准包括FEV1或DCLO≤50%;次要标准包括FEV1或DLCO在51%-60%之间、高龄≥75岁、肺动脉高压、LVEF≤40%、静息或运动状态下PaO2 <55 mmHg和pCO2> 45mmHg。4
' N4 c4 g8 V- v% ?5 K●如果介入放射科医生或中心不能确定IGTA的可行性或安全性,请考虑从经验丰富的大专业中心获取其它介入放射科专家的意见。
1 T' k. \) }% p1 f% x ! q1 N3 U+ b( N( p( I
消融% F1 z5 \% Q, W! T6 v
●每种能量方式都各有优缺点。确定用于消融的能量方式时应考虑靶肿瘤的大小和位置、并发症的风险以及当地的专业水平和/或操作者的熟悉程度。75 M7 u) |% F* t/ N! s3 |6 a; G
x2 f1 F$ U% d+ @( |' ^. qNSCLC的消融
8 Y: G1 ]* ?! }6 f●IGTA是治疗<3cm的NSCLC病灶的一种选择。>3cm的NSCLC病灶消融可能与局部复发和并发症发生率更高相关。8,9- L& k* \# }+ }# x
●有证据表明,IGTA可用于某些选择性的1A期NSCLC患者(患有多原发肺癌)、或有症状的局部胸腔疾病局部-区域复发的患者。& ^0 f) |3 ]" J" x: S
. {7 e5 V$ e% f6 m1 b参考文献:* y! P6 ?7 n |7 w% b/ G
1.Lam A, Yoshida EJ, Bui K, et al. Patient and facility demographics related outcomes in early-stage non-small cell lung cancer treated with radiofrequency ablation: a National Cancer Database analysis. J Vasc Interv Radiol 2018;29:1535-1541.$ f1 w* r: Z+ s
2.Dupuy DE, DiPetrillo T, Gandhi S, et al. Radiofrequency ablation followed by conventional radiotherapy for medically inoperable stage I non-small cell lung cancer. Chest 2006;129:738-745.
; M/ t0 |: ]3 a) S8 F+ G8 Z9 Q3.Lencioni R, Crocetti L, Cioni R, et al. Response to radiofrequency ablation of pulmonary tumours: a prospective, intention-to-treat, multicentre clinical trial (the RAPTURE study). Lancet Oncol 2008;9:621-628.
4 D5 g! w6 T# \) W) w% W4.Dupuy DE, Fernando HC, Hillman S, et al. Radiofrequency ablation of stage IA non-small cell lung cancer in medically inoperable patients: Results from the American College of Surgeons Oncology Group Z4033 (Alliance) trial. Cancer 2015;121:3491-3498.% ]) Z% y/ ` ^( y
5.de Baere T, Tselikas L, Woodrum D, et al. Evaluating cryoablation of metastatic lung tumors in patients--safety and efficacy: The ECLIPSE Trial--interim analysis at 1 year. J Thorac Oncol 2015;10:1468-1474.
* m5 a' b# r, m. g: r2 Z6.Tada A, Hiraki T, Iguchi T, et al. Influence of radiofrequency ablation of lung cancer on pulmonary function. Cardiovasc Intervent Radiol 2012;35:860-867.
. u- y& P* G: L' B5 s7.Abtin F, De Baere T, Dupuy DE, et al. Updates on current role and practice of lung ablation. J Thorac Imaging 2019;34(4):266-277.; Q/ z1 G4 ?7 J+ w- ]
8.Lee JM, Jin GY, Goldberg SN, et al. Percutaneous radiofrequency ablation for inoperable non-small cell lung cancer and metastases: preliminary report. Radiology 2004;230:125-134.
* R! A' c3 A: s9.Akeboshi M, Yamakado K, Nakatsuka A, et al. Percutaneous radiofrequency ablation of lung neoplasms: initial therapeutic response. J Vasc Interv Radiol 2004;15:463-470.6 x3 b3 S9 B3 R* |# C
________________________________________
* s% k% }- [4 C* M. [
; D4 R/ U0 i2 |9 O新辅助和辅助治疗的系统性治疗方案(NSCL-E)# {" Q# N. J4 J( E3 r' m8 r
3 j+ R& Y0 b, T8 w4 b
首选方案(非鳞癌)
; D0 q4 {; ~; |●顺铂75mg/m2,第1天;培美曲塞500mg/m2,第1天,每21天为一个周期,共4个周期1- g9 Q6 z0 s1 G" x% [7 }: d# h
* g6 `# W0 H R; j% S0 `0 F
首选方案(鳞癌)
* ~2 T# }/ ^: O●顺铂75mg/m2,第1天;吉西他滨1250mg/m2,第1、8天,每21天为一个周期,共4个周期23 l/ _5 N8 _ n% d2 Q( U) S
● 顺铂75mg/m2,第1天;多西他赛75mg/m2,第1天,每21天为一个周期,共4个周期3+ y$ v Q3 Y7 e1 b S
F+ h, B6 f& c& W
其它推荐方案
, o. C8 X* c; ]1 X+ H2 A● 顺铂50mg/m2,第1和第8天;长春瑞滨25mg/m2,第1、8、15、22天,每28天为一个周期,共4个周期4 2 }7 J3 }$ B( a( w. S$ z
●顺铂100mg/m2,第1天;长春瑞滨30mg/m2,第1、8、15、22天,每28天为一个周期,共4个周期5,6
9 z/ T B: m# Z9 l+ G●顺铂75-80mg/m2,第1天;长春瑞滨25-30mg/m2,第1、8天,每21天为一个周期,共4个周期/ ?* ?* a1 p, ]" w
● 顺铂100mg/m2,第1天;依托泊苷100mg/m2,第1-3天,每28天为一个周期,共4个周期5
$ U: M9 v% [0 e' C( U5 t
* D+ l1 ]' T7 l+ b8 Q8 W! x用于某些情况的方案$ m+ g0 K" _0 b: [& ]; t" z! M
用于有合并症的患者或无法耐受顺铂治疗患者的化疗方案
, m& m6 P( q9 {2 G8 o►卡铂AUC 6,第1天,紫杉醇200mg/m2,第1天,每21天为一个周期,共4个周期73 c6 X7 |/ U% ^/ E. ?0 r
►卡铂 AUC 5,第1天;吉西他滨1000mg/m2,第1、8天,每21天为一个周期,共4个周期8) i' |0 R, e. @7 k# I6 H, Y
►卡铂 AUC 5,第1天;培美曲塞500mg/m2,第1天,用于非鳞癌,每21天为一个周期,共4个周期9" U# v- O. i$ k/ d1 x
# k) Q) P3 i& M# K
所有方案均可用于序贯化疗/放疗
( ~$ [' F/ ^1 D: \& ]# ]7 n; w
. V# ]+ }/ ~! B; p+ z9 }9 j. Q先前接受了辅助化疗或不适合接受以铂类为基础的化疗" A3 k" U9 F) [3 {9 v
●奥西替尼 80 mg qd10# l8 y* \) W& O7 Y V
►对于手术完全切除的IB-IIIA期EGFR突变阳性NSCLC的患者,如果先前接受了辅助化疗或不适合接受以铂类为基础的化疗,考虑使用奥西替尼。
6 \$ n# V5 S4 q% t________________________________________" K+ x9 `" Q6 H2 F5 x4 x; H' h
p. P2 c6 W0 n7 |9 e h9 f C
同步放化疗方案(NSCL-F) 7 H1 p9 p& d0 f3 j) f
$ l1 F5 ~' J, u- b
同步化疗/放疗方案&
/ h: _( b I- D' [: Y5 ]首选方案(非鳞癌)4 K4 x% A9 H; I
●卡铂AUC 5,第1天,培美曲塞500mg/m2,第1天,每21天为一个周期,共4个周期;同步胸部放疗1,*,†,‡
+ r) V+ S. @% ?; \; | l! ]●顺铂75mg/m2,第1天,培美曲塞500mg/m2,第1天,每21天为一个周期,共3个周期;同步胸部放疗2,3,,*,†,‡±额外4个周期的培美曲塞500mg/m2,†
@+ L6 g: V: m1 [9 V: s! F●紫杉醇每周45-50mg/m2;卡铂AUC 2,同步胸部放疗4,*,†,‡±额外2个周期的紫杉醇200mg/m2和卡铂AUC 6†,‡0 N; x- D2 N. `" q' @
●顺铂50mg/m2,第1、8、29和36天;依托泊苷50mg/m2,第1-5、29-33天;同步胸部放疗5,6,,*,†,‡1 W7 H! A$ Y0 K' g
& Q% R4 l8 W, `0 l Q
首选方案(鳞癌)6 v% I- ~' T U+ p/ u
●紫杉醇每周45-50mg/m2;卡铂AUC 2,同步胸部放疗4,*,†,‡±额外2个周期的紫杉醇200mg/m2和卡铂AUC 6†,‡! T# h3 P" E5 u8 F
●顺铂50mg/m2,第1、8、29和36天;依托泊苷50mg/m2,第1-5、29-33天;同步胸部放疗5,6,,*,†,‡$ J* D9 G4 r9 _, w3 w: X$ S
n- w$ a9 i5 i8 o X% _* U7 f% `8 A" z2 D3 A5 H8 a4 ]# D
用于无法切除的II/III期 NSCLC、PS评分 0-1分并且在接受2周期或2周期以上的根治性放化疗后没有出现疾病进展的患者的巩固治疗
" V6 ^. ^- s) \3 p5 S, dDurvalumab 10 mg/kg IV,每2周1次,共至12个月7(用于III期患者使1类证据;用于II期患者是2A类证据)0 `" m2 G1 z% z$ S
+ Q3 @' P" M3 a) q2 u+ b5 G$ K脚注:
( ]) F4 _) T; v! i&.对于肺上沟肿瘤患者,建议与放疗同步进行2个周期,手术后再进行2个周期。Rusch VW, Giroux DJ, Kraut MJ, et al. Induction chemoradiation and surgical resection for superior sulcus non-small-cell lung carcinomas: long-term results of Southwest Oncology Group Trial 9416 (Intergroup Trial 0160). J Clin Oncol 2007;25:313-318.& F6 ^: B) Y' [( M% d6 j2 t) t
*.方案可用作术前/辅助化疗/放疗。
0 K$ D- `. ?9 ?4 t% W) R†.方案可用作根治性同步化疗/放疗。2 F, d; q3 c$ Q' T+ Q/ @! u8 _8 K0 X
‡.对于符合适应症的患者,Durvalumab可在上述任何同步化疗/放疗方案之后使用。8 S3 I" q9 U" J% m
§.如果使用durvalumab,患者未在放疗的时候同步接受全剂量化疗,则不建议再额外进行2个周期的化疗。
* J7 |" O7 r! v7 v/ d! b: P3 A" _________________________________________
1 L% M( @5 x# K$ o- A6 s
& q0 I) i6 R; @8 j. e7 k癌症生存者照护(NSCL-G)
7 \" l6 |* J; C + \/ H5 y2 _% T
非小细胞肺癌患者的长期随访照护
( G- f# Z6 r% u9 U# b$ p6 {$ E8 J●癌症监测(见NSCL-16)
' H+ A6 m! V6 {& W( F●免疫接种; j( G2 U/ ~- p, E
►每年接种一次流感疫苗3 {9 q; D, j1 t/ D" ]
►接种带状疱疹疫苗7 ]( u3 `& t& R# P
►酌情接种和再次接种肺炎球菌疫苗3 Z: H' ^% @' T8 Z+ D
% B% I! }% t* n! t3 U* [
促进健康的辅导1
+ J, S- ?! C+ [& ^●维持健康的体重, `# R+ Z6 J& w( S5 ~" W
●养成积极运动的生活方式(规律的体力活动: 一周中四天以上每天都应进行30分钟中等强度的体育运动)。' b# K; F6 n6 Q" r9 R8 a* R+ m9 Q
●健康饮食,以植物类为主。* m5 x4 Z5 G/ t4 q: g/ g
●如果饮用酒精类饮料,应限制酒精的摄入。9 m' M% d- `. O: b% }
( j1 F% ^4 ]) z Z- H8 H; Y其它健康监测
3 J, G1 Q5 c7 @, M$ ?● 常规血压、血脂、血糖监测
$ V# s4 Q6 v: h, z \8 D●骨健康:酌情行骨密度检测( U t7 c4 q% N. a. p2 w/ I
●口腔健康: 常规口腔检查( k3 c+ J1 O6 j5 @7 r8 ~. G2 r4 c
●日常防晒
$ g- ~1 a$ x3 k; z- m% J " p7 _/ |# q' D% g6 X
资源5 y7 v5 J2 }: I: c$ B8 }
●美国国家癌症研究所:癌症治疗后的生活, s" [4 }/ t- E/ g/ C
http://www.cancer.gov/cancertopics/life-after-treatment/allpages
/ q: h! b' D2 f6 H+ y4 R 7 [. l- E5 p0 e/ S7 C3 u9 q! F
癌症筛查建议2,3
" w- Y/ C7 @* M: j$ U! v以下建议适用于标危人群,高危患者应予个体化管理。
8 h8 o! I, i3 i" O●结直肠癌:参见《NCCN结直肠癌筛查指南》
' A" G1 W5 m) x* {# S6 K●前列腺癌:参见《NCCN前列腺癌早期检测指南》4 a# D3 p: i: p. G r/ m5 ~ H
●乳腺癌:参见《NCCN乳腺癌筛查指南》
0 K' h5 Y* ^# Z5 U8 y
6 m' d1 j; d% j3 Z. a1 n$ {脚注:
- v$ A3 D4 u$ H1.美国癌症协会关于癌症预防的营养和体育运动指南:
$ D3 t6 C/ o2 j m/ x* lhttp://www.cancer.org/healthy/ea ... index?sitearea=PED.
- ?) X3 F& F5 x8 C/ J/ e n8 N2.纪念斯隆凯特琳癌症中心的筛查指南:; ]( T1 \7 @$ G" l
https://www.mskcc.org/cancer-car ... reening-guidelines.+ |8 r! P9 D* L! f5 t+ w+ y8 p
3.美国癌症协会的癌症早期检测指南: b: a" F7 `( Z$ A
http://www.cancer.org/healthy/fi ... detection-of-cancer?sitearea = PED.
( i3 c5 Z7 P. b" d2 E$ G8 U- f7 Y
2 C4 s4 \8 g3 \1 Q7 N
 9 H7 ^! e9 y2 M4 g
9 H7 ^! e9 y2 M4 g ; _2 F l/ v3 x- l! G8 L! V
分子学检测和生物标志物分析原则(NSCL-H)' E" i* ]5 E5 C* o
' _" D: i/ I( v1 J& y y( @* rNSCL-H,1/5# Z( y' ~4 C* |) L# S
分子学检测的注意事项、标本要求、检测方法9 y3 f. D/ u! J9 h
9 b4 F$ p5 ^& X- o0 z" T' C* C
非小细胞肺癌的分子诊断学检查
: g- y `. _5 }7 R5 `●已确定许多基因的变异会影响治疗方案的选择。检测肺癌标本的这些基因变异,对于确定潜在有效的靶向治疗以及避免不太可能提供临床获益的治疗是重要的。; ~( W2 L- E/ J4 l7 O
●用于选择靶向治疗的一些方法包括预测性免疫组化分析,这与用于确定肿瘤类型和谱系的免疫组化检查不同。% T8 ^" e+ g6 Q8 L+ m
●对分子学结果的应用和解读至关重要的分子学检测的主要要素包括:% c: L: g$ r& z
►在经过适当认证的实验室进行检测,至少有CLIA认证
8 {& j1 e. w+ H3 c6 `6 x# L7 X►理解所使用的方法学以及这些方法的主要局限性6 u/ O3 Z( R$ i" X/ H2 O
►理解通过一种特定分析方法可检测变异的范围(以及那些未检测的变异)
( S1 e R6 x8 H0 l, N►在检测前,了解肿瘤标本是否进行过病理学检查和肿瘤富集(即显微切割、肉眼分离)
; x+ b: p. ~& F% @" M# G►检测实验室接受的样品类型+ P, z# Y5 W- Z1 p) H/ Q6 D$ x
●标本采集和管理:, k: u) v$ r1 K
►虽然肿瘤检测已主要集中在使用福尔马林固定石蜡包埋(FFPE)的组织,但是,越来越多的实验室接受其它类型的标本,尤其是未通过FFPE流程处理的细胞病理学涂片。尽管FDA批准的多种伴随诊断分析不包括对细胞块的检测,但是当它是唯一或最好的材料时,强烈建议对这些样本类型进行检测。7 Y5 n7 u8 E9 K* p4 x$ V6 ?$ q
►当使用微创技术获取的样本来进行非小细胞肺癌的分子学检测时,存在的一个主要局限性是:样本量可能不足够用于分子、生物标志物以及组织学检查。因此,为了能够进行所有适当的检测,支气管镜操作医生和介入放射科医生应该获取足够的组织。
+ m- i+ A/ M% M' r►当组织极少时,实验室应有效地利用技术来最大限度地利用组织进行分子学和辅助检查,包括小活检样本组织学检查专用协议、包括用于诊断和预测性检测的“预”滑动切片。; v2 F- J, E1 \/ `0 U0 e
●检测方法
* |3 |0 F( v1 F$ G6 ?( L►以下分别列出每一种适当可行的检测方法;然而,通常考虑联合使用几种方法:
e- c+ w* Z. m0 Z3 B O◊二代测序(NGS)用于临床实验室。单独NGS分析并不能检出所有变异类型,熟悉单独分析或联合分析可识别的变异类型是很重要的。
7 b5 z$ Y2 w) Q9 V! B4 W) [◊建议此时在可行的情况下通过基于广泛组合的方法进行检测(最常采用NGS)。对于在广泛组合的检测中未发现驱动癌基因的患者(尤其是从不吸烟者),请考虑行基于RNA的NGS检测(如果尚未进行)以最大程度地发现融合事件。
" y6 A0 X# m& H0 }◊实时聚合酶链反应(PCR)是一种具有高度针对性的检测方法(针对特定突变)。采用该技术只能针对那些特定的改变进行检测评估。! A) V: {! U4 @7 N W* A5 c, |
◊桑格测序需要最大程度的肿瘤富集。未改良的桑格测序不适合用于富集后肿瘤含量仍不足25%-30%的标本的突变检测,且重要的是要认识到它不适合用于分析识别亚克隆事件(如耐药突变)。如果使用桑格测序,几乎都建议使用肿瘤富集方法。
7 {& K: x% I1 l; @◊可使用的其它方法,包括上面未列出的复合方法,如SNaPshot技术(美国应用生物公司(ABI)开发,是一种基于荧光标记单碱基延伸原理的分型技术,也称小测序,主要针对中等通量的SNP分型项目)、MassARRAY(核酸质谱分析系统])。- e( I( L3 ]2 f7 K2 H% e
◊荧光原位杂交(FISH)分析用于拷贝数、扩增以及结构改变如基因重排等许多分析检查。
6 Z. `' C2 H: ~# |1 c5 s4 @0 ^, \◊免疫组化(IHC)专门用于某些特定分析,可作为一个有用的替代或其它分析的筛选方法。
$ t5 ?9 {& `8 |- l Y1 m 9 S4 K! w4 a' W1 k- p, w$ }: P
NSCL-H,2/5
+ q4 y) [) [' V3 fEGFR
( h6 v/ f! {9 t% J% A: J. ?0 S! [1 J4 [, |
●分析的分子靶点
( y" y8 `6 Y- V& K►一般而言,观察到的下述突变/变异是非重叠的,尽管有1%–3%的非小细胞肺癌可能有并存的变异。4 \( P- Q- l& E" D8 H
►EGFR(表皮生长因子受体)基因突变:EGFR是一种受体酪氨酸激酶,通常见于上皮细胞表面,经常在多种人类恶性肿瘤中过表达。$ n8 X4 X+ o A$ A0 x. Z# @! n
◊最常描述的EGFR突变(19外显子缺失、21外显子p.L858R点突变)与对EGFR酪氨酸激酶抑制剂(TKI)治疗起效相关;最新数据表明,没有EGFR敏感突变的肿瘤在任何线的治疗中均不应使用EGFR TKI。
; T" L. M' j3 P7 Z9 q& E◊考虑在诊断性活检或手术切除后的样本上增加针对EGFR突变的分子学检测,以确保EGFR突变检测结果可用于IB期—IIIA期NSCLC患者的辅助治疗决策。- B0 R% D5 S. D: j
◊许多较不常见的EGFR变异,累计占EGFR突变NSCLC的~10%(即19外显子插入、p.L861Q、p.G719X、p.S768I)也与对EGFR TKI治疗起效相关,尽管研究的患者数较少。! l# [. P2 P( {; R$ s7 z: M: m# P
◊EGFR外显子20(EGFRex20)突变是一个混杂组,其中一些对靶向治疗有反应,需要详细了解具体的变异。
/ D* ~5 I( w2 |—EGFR p.T790M突变是最常观察到的引起对第一代和第二代EGFR TKI耐药的一种机制。对于以p.T790M为主要耐药机制的第一代或第二代TKI药物治疗中疾病进展的患者,第三代TKI通常有效。如果在先前没有接受过EGFR TKI治疗的情况下观察到p.T790M,则必须进行遗传咨询和可能的胚系基因变异检测。; d: G7 T2 Q, o$ e y- k* e
—其它大多数EGFRex20变异是框内重复或插入突变的一个多元化组。* {) s6 E! }8 O7 I; ?3 W" Y
▪ 这些变异通常与对EGFR TKI缺乏疗效有关,但以下情况除外:
- Q5 k% ^9 E6 c# V: c+ e5 Op.A763_Y764insFQEA与对TKI治疗的敏感性有关
4 L- d( |0 k# E8 n0 h3 hp. A763_Y764insLQEA可能与对TKI治疗的敏感性有关
1 x" R) }/ i4 y$ Z: K- F▪ 由于这个原因,EGFRex20插入突变的具体序列很重要,一些检测方法会在不报告具体序列的情况下鉴定是否存在EGFRex20插入。在这种情况下,需要进行其它测试以进一步阐明EGFRex20插入。* N8 e( D; V0 W0 g$ \
◊随着NGS检测使用的增加,发现了越来越多的其它EGFR变异;然而,不太可能很好地确认个体变异的临床意义。6 P: g8 D5 j" M& ^, q. J1 B7 X
◊某些临床病理特征(如吸烟状况、种族、组织学)与EGFR突变的存在相关;然而,这些特征不应用于挑选进行检测的患者。
; t4 E/ a2 \) |9 r, Z◊检测方法:检测EGFR突变状态的方法有实时PCR、桑格测序(理想的是配以肿瘤富集)以及最常用的NGS。
; J1 y2 M2 q0 O! r
+ @ {5 `* a3 ~. u: ?NSCL-H,3/5* e: O4 B. `" l# e0 e% M
ALK、ROS1、BRAF、KRAS# k! \$ M5 q- L, B
& d! c. k/ L3 J8 Y2 Z►ALK(间变性淋巴瘤激酶)基因重排:ALK是一种受体酪氨酸激酶,可在非小细胞肺癌中重排,导致通过ALK激酶域的信号失调和失当。' }3 k! B# m* O# _
◊ALK最常见的融合伴侣是棘皮类微管相关样蛋白4(EML4),尽管已经发现了许多其它融合伴侣。
: F( `# S+ M; i8 z( L( @& u9 d+ q◊存在一种ALK重排与对ALK TKI起效相关。
/ m6 u0 k* N7 E( Y* l3 W$ b5 e◊某些临床病理特征(如吸烟状况和组织学)与ALK重排的存在相关;然而,这些特征不应用于挑选进行检测的患者。4 _- X& M9 ~7 r) G8 L, \. r' |9 j% J
◊检测方法:分离FISH探针是第一个被广泛采用的方法。免疫组化可作为一种有效的筛选策略。FDA批准的IHC(ALK [D5F3] CDx分析)可作为独立检测,不需要FISH确认。许多NGS方法可以检测ALK融合,在某些情况下使用定向实时PCR法,虽然不太可能发现与新的伴侣融合。
0 `4 @* y/ O2 x8 c+ ^" n►ROS1(ROS原癌基因1)基因重排:ROS1是一种受体酪氨酸激酶,可在非小细胞肺癌中重排,导致通过ROS1激酶域的信号失调和失当。
9 `% h5 c- G3 q◊ROS1有许多融合伴侣,常见的融合伴侣包括:CD74、SLC34A2、CCDC6和FIG。
0 o2 ]! N) ^$ ~ }" f% x2 O! [8 O◊存在一种ROS1重排与对口服ROS1 TKI起效相关。$ H7 K8 |4 n1 O6 L4 ~
◊某些临床病理特征(如吸烟状况和组织学)与ROS1重排的存在相关;然而,这些特征不应用于挑选进行检测的患者。
( {6 U# U3 g6 j3 k' v◊检测方法:可以采用分离FISH探针法;然而,它可能检测不出FIG-ROS1变异。可以采用IHC;然而,免疫组化用于检测ROS1融合的特异性低,因此如果使用ROS1 IHC作为一种筛查手段,后续的验证性检测是一个必要的组成部分。许多NGS方法可以检测ROS1融合,但是基于DNA的NGS可能检测不出ROS1融合。在某些情况下使用定向实时PCR法,虽然不太可能发现与新的伴侣融合。) I( w5 t8 c X5 [
►BRAF(B-Raf原癌基因)点突变:BRAF基因是一种丝氨酸/苏氨酸激酶,是典型的MAP/ERK信号通路的一部分。BRAF激活突变导致通过MAP/ERK通路的信号失控。
* r8 X# ]+ Q# h+ g2 Q9 |, W◊BRAF突变可见于非小细胞肺癌中。已发现一个导致p.v600e改变的特定突变的存在与联合口服BRAF与MEK抑制剂治疗起效相关。 E. w d4 W. f* B, U" \, f
◊应注意BRAF的一些其它突变也可见于非小细胞肺癌中,这些突变对治疗选择的影响目前尚不太清楚。+ O y- L' ~, @( Z6 |
◊检测方法:检测BRAF突变状态的方法有实时PCR、桑格测序(理想的是配以肿瘤富集)和最常用的NGS。尽管抗-BRAF p.V600E特异性单克隆抗体可在市场上买到,而且在一些研究中使用了这种方法进行检查,但是,只能在经过大规模的验证之后才能使用。% }( b" I/ k. i( ~7 K* u
►KRAS(KRAS原癌基因)点突变:KRAS是一个本身具有GTP酶活性的G-蛋白,活化突变将导致通过MAP/ERK通路的信号失控。, l# I! u: d2 {! Z- B$ |
◊在非小细胞肺癌中的KRAS突变最常见于12密码子,虽然可以见到其它部位的突变。$ d* G9 b' U( j
◊与肿瘤无KRAS突变的患者相比,存在一种KRAS突变预示生存期差。
! y7 f) v; T l◊KRAS突变与对EGFR TKI治疗的疗效降低相关。! Z$ d1 X& @1 o9 ]% g# }5 m( d
◊由于出现可以靶向的重叠变异的可能性较低,因此,存在一种已知KRAS激活突变可以识别将不可能从进一步分子检测中获益的患者。6 |; o) ~( \6 W# C; p+ m" j
& S: S. |# P7 l, ANSCL-H,4/5, m9 P2 _( M1 }% E" e
MET、RET、NTRK、靶向治疗中进展情况下的检测2 t3 h4 t7 [8 X! g G
+ L4 D4 U! [6 I% A$ k►MET(间质-上皮转化)外显子14(METex14)跳跃变异:MET是一种受体酪氨酸激酶。在NSCLC中,可能发生导致外显子14缺失的突变。METex14的缺失会导致调节失调和不适当的信号传导。
7 I' T" f* }- [- n: b◊METex14跳跃突变的存在与对口服MET TKI的反应性相关。: D% M) z( G. m c
◊一系列的分子学变异导致METex14跳跃。0 ~: I3 @$ S+ G9 q- v1 A5 r2 ^
◊检测方法:基于NGS的检测法是检测METex14跳跃事件的主要方法,基于RNA的NGS显示出检测的改进。IHC不是检测METex14跳跃的方法。, Z2 q( z5 |( {4 U" f7 P0 r
►RET(转染过程中重排)基因重排:RET是一种受体酪氨酸激酶,可以在NSCLC中重排,通过RET激酶结构域导致失调和不适当的信号传导。9 L7 i, ^. v: v3 n5 e/ T5 b
◊常见的融合伴侣是KIF5B、NCOA4和CCDC6;但是,已经确定了许多其它融合伴侣。
w* N; T7 G3 c9 h$ w. }◊RET重排的存在与对口服RET TKI的反应性相关,而与融合伴侣无关。3 G; |0 g! l9 o, m9 ]0 _
◊检测方法:可以使用FISH Break-Apart探针方法;但是,它可能检测不到一些融合。靶向实时逆转录酶PCR分析法用于某些情况,尽管它们不太可能检测到与新型伴侣的融合。基于NGS的方法具有高特异性,并且基于RNA的NGS用于融合检测优于基于DNA的NGS。
) k% j3 x6 o' |2 s2 s►NTRK(神经营养因子受体酪氨酸激酶)基因融合
4 u# v4 }4 n( j# J6 j( t0 F◊NTRK1/2/3是酪氨酸受体激酶,在NSCLC和其它肿瘤类型中很少重新排列,发生重排将导致信号失调和失当。. I4 D$ D/ l z; r' v2 ~
◊已经确定了有许多融合伴侣。
5 N! ?1 f4 J$ q+ Q; x3 i◊迄今为止,除了没有其它驱动改变外,尚未发现与这些融合相关的任何特定的临床病理特征。
; \2 n( [6 A8 Z3 Q9 B$ g* y+ X◊NTRK1/2/3中的点突变通常是非激活性的,尚没有其与靶向治疗相关性的研究。
) _. v* e8 G" _6 a' A# q◊检测方法:可以使用多种方法来检测NTRK基因融合,包括:FISH、IHC、PCR和NGS;可能出现假阴性。IHC法由于在一些组织中存在基础表达而变得复杂。FISH检测法可能至少需要3组探针才能进行全面分析。NGS检测法可以检测到广泛的变化。基于DNA的NGS可能检测不到NTRK1和NTRK3融合。! u2 Q9 u: v6 R3 t
●对于在治疗开始之前无法合理完成对所有生物标志物全面评估的病例,如果病灶可以进行取样和检测,考虑在一线治疗中出现疾病进展时复查基因组合测序或选定的生物标志物检测。. w. M& d* u+ v! p3 U5 k
●靶向治疗中进展情况下的检测:
; k$ B, m" g. w' V►对于上述列出的许多分析物,人们对治疗耐药分子机制的认识逐渐增加。对靶向治疗中活跃进展的标本进行重新检测,可为制定下一步合理的治疗方案提供线索:2 f- V0 }* P9 y
◊对于已经接受过EGFR TKI治疗、具有潜在EGFR敏感突变的患者,合理的检测最起码应包括高敏感性的p.t790M评估;当没有p.T790M的证据时,检测其它耐药机制(MET扩增、ERBB2扩增)来指导患者接受其它治疗。p.T790M是否存在,可指导患者接受第三代EGFR TKI治疗。% c- V# T4 y4 r3 r2 A4 k9 X% M. A
—检测EGFR p.T790M的分析法,分析灵敏度应该至少有5%的等位基因分数。如果p.T790M是在亚克隆事件中,初始敏感突变可用作许多分析的内部对照,以确定p.T790M是否在检测范围内。
4 v" |4 M8 P5 C% o5 m+ s% h◊对于已接受过ALK TKI治疗、具有潜在ALK重排的患者,尚不清楚识别特定酪氨酸激酶域突变是否可以确定下一步的合理治疗方案,尽管一些初步数据表明一些特定激酶域突变可影响下一线治疗。 e3 M/ i2 j- H, }3 ?
( }3 V3 C6 X/ vNSCL-H,5/5
+ o) z" w4 ~* u" GPD-L1、ctDNA检测( E w3 |) r# p9 i! ?
5 e. F; r0 d+ R3 p$ y! O( t●PD-L1(程序性死亡配体1):PD-L1是一个可以表达于肿瘤细胞的共调节分子,抑制T细胞介导的细胞死亡。T细胞表达PD-1,一个负调控因子,与配体(包括PD-L1[CD274]或PD-L2[CD273])结合。存在PD-L1时,T细胞活性被抑制。2 F; f# k+ `# O: T; j5 r' q
►检查点抑制剂抗体阻断PD-1和PD-L1的相互作用,从而提高内源性T细胞的抗肿瘤作用。
7 d, p3 ?4 Z3 R% d: c. J►可以利用IHC检测PD-L1以识别最可能对一线抗PD-1/PD-L1治疗起效的肿瘤。" J6 H% T$ O; s! b+ ^% T
◊已经开发出用于IHC分析PD-L1表达的各种不同的抗体克隆,一些呈现相对等价,一些则不等价。
" @; m5 K! x) f0 B: {3 X& o◊ PD-L1 IHC的判读通常关注表达任何水平膜染色的肿瘤细胞的比例,因此是一种线性变量,在其它一些肿瘤类型中评分系统可能不同。* T' Z$ _( Z: _ I
◊FDA批准的PD-L1伴随诊断方法可指导帕博丽珠单抗用于治疗NSCLC患者,是基于肿瘤比例评分(TPS)。TPS是在任何强度下显示部分或全部膜染色的活的肿瘤细胞的百分比。, j3 ~3 b: T! L5 H$ c( k
◊检测结果阳性和阴性的界定取决于使用的特定抗体和平台,其对每一种检查点抑制剂治疗可能是唯一的。有可能用于检测PD-L1的多种不同方法已增加了病理科医生和肿瘤科医生的困扰。
7 \; V( f5 S$ o5 @◊尽管在携带驱动突变的患者中,PD-L1表达可以升高,但针对致癌驱动突变的靶向治疗应优选于免疫检查点抑制剂治疗。
; p1 a, \: c( c0 ?●血浆游离细胞/循环肿瘤DNA检测6 G/ c& Z2 m! F! q8 Z
►不应使用游离细胞/循环肿瘤DNA检测来代替组织学诊断。
6 y/ b% m I- s) n►一些实验室提供外周循环中核酸分子改变的检测,最常见于经处理的血浆中(有时称为“液体活检”)。 \8 V. Q9 M* s4 y3 Z( x+ A
►一些研究表明:游离细胞肿瘤DNA检测通常具有非常高的特异性,但灵敏度明显折损,假阴性率高达30%。6 |" L0 g8 y! o9 L! }$ L# l
►尚未确立游离细胞肿瘤DNA分析性能特征的标准,与基于组织的检测相比,没有关于此类检测性能特征的指南。
/ n7 W" g, i* c- `►游离细胞肿瘤DNA检测可发现与一些与所关注的病变无关的改变,如:不确定潜能的克隆性造血(CHIP)。
" l/ F4 o* W& ~0 O►在一些特定的临床情况下,可以考虑使用游离细胞/循环肿瘤DNA检测,尤其是:
; g8 m5 f# b2 R6 C- K X. i$ {◊如果患者的全身状况不适合行有创的组织取样。5 Z- Q8 v; [2 V7 z; u8 `
◊初诊时,如果在病理确诊为非小细胞肺癌后没有足够的样本行分子学分析,则只有在有计划对所有游离细胞/循环肿瘤DNA检测未发现致癌驱动突变(有关可用的靶向治疗选项的致癌驱动因素,请参见NSCL-18)的患者接着行基于组织的分析时,才能行该项目(游离细胞/循环肿瘤DNA)检测。6 ?! x* E+ I7 U
________________________________________) l# B1 J6 Y7 Z% L. v( I6 l* f' x) k
9 q% ?( ], r& j, l. n( k
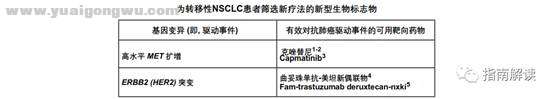
为转移性NSCLC患者筛选新疗法的新型生物标志物(NSCL-I)
, l4 Z) h( u6 c! U( j
$ u2 d- G9 c1 `. j; ` p# M0 a
 9 d# L2 M! @; W3 f
9 d# L2 M! @; W3 f
7 p4 |, u0 p7 V% M) @/ e参考文献:
3 z2 R7 `9 I. w6 u8 u" E1.Ou SH, Kwak EL, Siwak-Tapp C, et al. Activity of crizotinib (PF02341066), a dual mesenchymal-epithelial transition (MET) and anaplastic lymphoma kinase (ALK) inhibitor, in a non-small cell lung cancer patient with de novo MET amplification. J Thorac Oncol 2011;6:942-946.
3 k9 F( r' |3 L& _* |2.Camidge RD, Ou S-HI, Shapiro G, et al. Efficacy and safety of crizotinib in patients with advanced c-MET-amplified non-small cell lung cancer. J Clin Oncol 2014;32(Suppl 5):Abstract 8001.
+ j: a% j* d, v+ |7 [3.Wolf J, Seto T, Han JY, et al; GEOMETRY mono-1 Investigators. Capmatinib in MET exon 14-mutated or MET-amplified non-small-cell lung cancer. N Engl J Med 2020;383:944-957.
2 u6 R8 r7 @$ `5 ]0 i% g. f4 N4.Li BT, Shen R, Buonocore D, et al. Ado-trastuzumab emtansine in patients with HER2 mutant lung cancers: Results from a phase II basket trial. J Clin Oncol 2018;36:2532-2537. x: k1 g% H: x9 ?
5.Smit EF, Nakagawa K, Nagasaka Met al. Trastuzumab deruxtecan (T-DXd; DS-8201) in patients with HER2-mutated metastatic non-small cell lung cancer: interim results of DESTINY-Lung01[abstract]. J Clin Oncol 2020;38:Abstract 9504.
8 r! M% w/ Z; R, i5 N9 } p % b3 U4 T0 C" F w1 t. ?
 / M! k. i* r& _5 z- O3 R6 _
/ M! k. i* r& _5 z- O3 R6 _
# t, [" L0 m9 h
晚期或转移性肿瘤的靶向治疗(NSCL-J)
- i3 {2 E! q/ r5 M8 S5 C ! e* {( u1 O) f* q) T
NSCL-J,1/24 x& J4 [# c+ G9 W, D: g. J# O2 z+ G
治疗期间的监测、维持治疗的定义、给药方案0 c# ^/ Q& m9 L8 [ _5 t7 [
3 W* X% A) X% b$ E. u初始治疗期间的监测
L. }1 d+ j' X& U8 R- K. c●在2个周期后评估疗效,然后在每2-4个周期后或当有临床指征时行已知病灶部位的CT平扫加或不加增强扫描。
% T7 X; F3 X/ N w' a- N; W/ X
8 Y3 B$ S: C2 Q+ \& r后续治疗期间的监测
$ R+ l: ^, j/ d3 p●每6-12周对已知病灶的部位行CT扫描(加或不加增强扫描)进行疗效评估。指南参数内的CT扫描时间是根据临床决策。# x. q% ?2 ] }5 R6 h- T
2 C9 l" w% c8 k# R! ^% ^1 z
 5 L2 t5 b# u& _5 q! F0 L7 ~
5 L2 t5 b# u& _5 q! F0 L7 ~ ) p2 s( R b5 E0 M% Y( Z
脚注:
5 w. v, L4 E; a! [*.持续维持治疗是指在没有疾病进展的情况下使用一线治疗中给予的至少一种药物>4-6个周期。
6 k& k1 C' A9 v**.FDA批准的一种生物类似药可用于替代贝伐单抗。
) v# K+ I {8 G7 K2 Y( R7 |
- P) R" u; w& @1 E* V% NNSCL-J,2/2* I$ |7 J, N+ O+ I; l$ `
参考文献
2 |7 |( v" b9 @: {2 H$ U2 w* [
, m+ Y* l! ]3 P% I8 }7 q5 c
 , v" n1 R, d# ]3 I( s/ I4 ^% O% {1 o
, v" n1 R, d# ]3 I( s/ I4 ^% O% {1 o ________________________________________
; z; d. z! m) q: W" a
* ^! l7 t6 y. |6 L0 b+ Z晚期或转移性肿瘤的全身治疗(NSCL-K)& _, B' w m% K
* I1 L* I Z u& h( BNSCL-K,1/5
* O, {6 y! r! ~% B# [6 ?& r/ Q晚期或转移性非鳞NSCLC的系统性治疗—初始系统性治疗选项a,b
" ? `3 h) y# v
! k! ]% `1 D" H4 A- F9 W6 w( n初始全身治疗选择
) g3 d0 D* z# g. D* t' ?
1 O. C5 H6 Z# c( W7 T' h6 X2 U
 , K. g# s' S A* P$ h0 S
, K. g# s' S A* P$ h0 S + v2 u! o2 }+ ], \1 n, f0 Y
脚注:
- W! a4 P1 K) L0 }9 H. Ea.在接受紫杉醇或多西他赛治疗的患者中,对于尽管经预处理用药仍有过敏反应者,或存在标准预处理(即地塞米松、H2受体阻滞剂、H1受体阻滞剂)禁忌症的患者,可用白蛋白结合型紫杉醇替代紫杉醇或多西他赛。; z) v. w1 V, r7 b! y j
b.基于卡铂的方案通常用于存在合并症的患者或那些不能耐受顺铂的患者。/ ~; Z5 W# n+ ]' e
c.使用PD-1/PD-L1抑制剂治疗的禁忌症可能包括:活动或先前确诊的自身免疫性疾病、和/或当前正在使用免疫抑制剂、或存在预测将缺乏获益的致癌基因(例如,EGFR[外显子19缺失、外显子21中的p.L858R点突变],ALK重排)。
' o' l/ [, \- }% Z' Dd.如果在接受PD-1/PD-L1抑制剂治疗期间出现进展,切换成另一种PD-1/PD-L1抑制剂不作为常规推荐。
; Q- ~- `! h- J, U8 Qe.FDA批准的一种生物类似药可用于替代贝伐单抗。
1 o- f: l* F; `5 C/ l: hf.贝伐单抗应给药直至疾病进展。
/ t0 I8 j7 a& Xg.任何具有血小板减少高风险和潜在出血风险的方案,联合贝伐单抗时均应谨慎。; v9 A1 q# K, P& V8 r. v9 H1 c/ M5 G
h.联合贝伐单抗治疗的标准:非鳞非小细胞肺癌并且近期无咯血史。贝伐单抗不应单独给药,除非初始治疗时与化疗联用而后单独作为维持治疗。+ F) D+ ~% ]3 ]' z- ]8 n- `( a& q
1 s* `3 `% i# b! ]/ X6 WNSCL-K,2/5
1 r% `4 O6 ^, j7 c5 I, p8 C0 J晚期或转移性鳞状细胞癌的系统性治疗—初始系统性治疗选项a,b; A2 ~. M) w2 \ _
+ d9 r8 U: Q/ e0 {8 p: Z: j初始全身治疗选择- D' v9 k& g- Z: Z" ]9 V f" c
7 m3 @) w$ }7 y
 : O: V" a# A: h8 o- \
: O: V" a# A: h8 o- \
# y) n- { v: F4 M7 s# e4 }脚注:! s# A7 d2 i) S9 }2 C* i8 E- t, s- ]
a.在接受紫杉醇或多西他赛治疗的患者中,对于尽管经预处理用药仍有过敏反应者,或存在标准预处理(即地塞米松、H2受体阻滞剂、H1受体阻滞剂)禁忌症的患者,可用白蛋白结合型紫杉醇替代紫杉醇或多西他赛。2 y( U3 g3 b/ b6 F2 g
b.基于卡铂的方案通常用于存在合并症的患者或那些不能耐受顺铂的患者。
% C4 l6 G) z5 O+ J) @) n/ wc.使用PD-1/PD-L1抑制剂治疗的禁忌症可能包括:活动或先前确诊的自身免疫性疾病、和/或当前正在使用免疫抑制剂、或存在预测将缺乏获益的致癌基因。
i0 ^6 J7 z3 l3 q C! `d.如果在接受PD-1/PD-L1抑制剂治疗期间出现进展,切换成另一种PD-1/PD-L1抑制剂不作为常规推荐。
- i, k# Y u+ t' ji.在NCCN成员机构中,“顺铂/吉西他滨/耐昔妥珠单抗”方案不用于鳞状细胞癌的一线治疗,阿法替尼不用于鳞状细胞癌的二线治疗(基于这些药物的疗效与安全性和其它可获取药物的疗效与安全性相比较)。. l& |, b% n3 F6 Y' O0 b0 H* Y
$ h+ s5 W, ]! i& I% X8 ~
NSCL-K,3/5
, y8 L+ U" h* k, q Y/ \- r晚期或转移性疾病的系统性治疗—维持治疗选项
: E) Z' p: w$ v7 m% O3 j9 w# P+ \
维持治疗8 d* n4 X2 e( Y I0 `* V/ }& M2 w
●继续维持是指接受4-6个周期初始治疗后,在没有疾病进展的情况下,使用至少一种一线方案中的药物继续治疗。切换维持是指接受4-6个周期初始治疗后,在没有疾病进展的情况下,开始使用一种不同的药物(不包含在一线方案中)进行治疗。! s7 O: A! c1 g b; y
●如果患者接受一线免疫治疗,则应接受两年的维持治疗。
: N8 b9 K# K3 T) k●如果患者接受二线免疫治疗,则应接受维持治疗直至疾病进展。5 h- _1 y2 v" X' k1 h* H
7 e( s7 L- a) n& }! U) z
 . E, I7 ~4 ?; [, F8 h! N' n
. E, I7 ~4 ?; [, F8 h! N' n $ T9 h& J* ^' |% b+ S& j5 D7 N
脚注:
# q; D$ o% j9 ~! Si.如果贝伐单抗与一线培美曲塞/铂化疗方案一起使用。" _1 J- C( w5 j- n& L3 O
j.如果先前接受帕博利珠单抗/卡铂/培美曲塞或帕博利珠单抗/顺铂/培美曲塞治疗。( x" \; e+ [2 [# [
k.如果先前接受阿替丽珠单抗/卡铂/紫杉醇/贝伐单抗治疗。: I$ I. @8 c# j2 ~; x
l.如果先前接受纳武利尤单抗+伊匹单抗±化疗。
/ y4 r2 ~( t0 y! ^! s9 {m.如果先前接受阿替丽珠单抗/卡铂/白蛋白结合型紫杉醇治疗。
" {3 K" N5 F A2 yn.如果先前接受帕博利珠单抗/卡铂/(紫杉醇或白蛋白结合型紫杉醇)治疗。" A; h) E: O2 d8 y
1 o7 j( W. x- D! ]
NSCL-K,4/50 Q# P9 r8 H( T; H; T
晚期或转移性疾病的系统性治疗—后续系统性治疗选项6 F$ X! u, E4 G0 t; L& M% x( H
1 N8 s0 \6 c" j4 D: _
 . c3 B& k$ \5 }1 j* }6 Y: V2 l1 W
. c3 B& k$ \5 }1 j* }6 Y: V2 l1 W
) s1 u+ {, f+ o1 U; d脚注:
: G8 R1 N7 s- q/ f+ U. L" Go.二线数据表明,PD-1/PD-L1抑制剂单一疗法在EGFR+/ALK+ NSCLC中的效果不佳,无论PD-L1表达如何。' M! f* i4 e6 J% ]! e
p.如果在使用PD-1/PD-L1抑制剂中出现疾病进展,不推荐换成另外一种PD-1/PD-L1抑制剂。/ B. w7 L4 k; V) Z* {
q.帕博利珠单抗被批准用于PD-L1表达水平≥1%(采用FDA批准的检测法确定)的NSCLC患者。& u& ?2 R2 Q% n! N5 F% g+ x7 k: I
r.如果先前没有用过。- N& A- b$ z0 U$ ^* j! y: k0 c/ u
& T) r- f% @, s. G) e, e
NSCL-K,5/59 F) l7 @6 B7 `4 V% l/ [5 T; _
参考文献 [4 `" u8 k; e4 J3 E9 ~
/ a6 O3 g+ E8 ~+ M9 H$ `( P: Z1 O' B
 " U1 U$ N9 F3 \; J
" U1 U$ N9 F3 \; J
________________________________________, V( q$ r* j: L+ l1 P. p% D
3 Z" v+ ^, C5 w1 H$ }分期(ST-1,2,3)
9 e) C4 Q( b& p3 C, n- X / s& `5 j7 j$ R% @; \
ST-1
; g9 t! }; u1 `: R+ Z+ |5 }T分类
! [' {/ x2 s8 v- T
% z7 E6 r, V0 l, t; u
 9 X# L% V1 g; o& B- [
9 X# L% V1 g; o& B- [
0 Y5 a* b( p' X. b1 H C5 HST-2
i6 J: ]2 O. {N、M分类和预后分组
" l% m8 K% `/ V; {, e6 ~$ z7 t+ ?5 G' e2 d5 A4 z$ F
 2 D/ n3 y" W3 J3 R8 I) _' L
2 D/ n3 y" W3 J3 R8 I) _' L ( W* n* {6 `0 M# J
ST-3
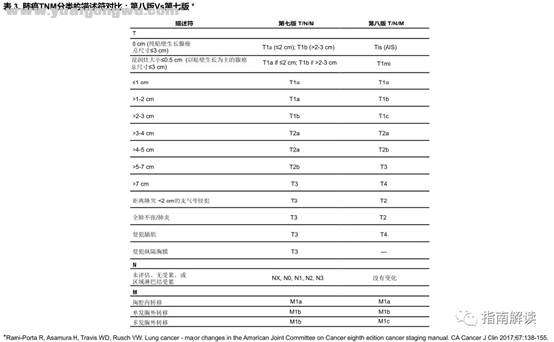
0 I0 u% ` |8 S& ^! ]+ n第八版和第七版TNM分类对比/ c* |% _! S; j! ]$ Q
9 w/ b; h% v% g' s: `2 O
 & I5 P4 o, A% l9 }# J2 g
& I5 P4 o, A% l9 }# J2 g
; P/ }' D5 V# K- Q; {( [ {8 | |